Cuando se combinan átomos de elementos metálicos con átomos de elementos no metálicos ( el camino que suelen seguir estos átomos para completar su última capa es que el átomo del metal pierde electrones y el del no metal los gane. Esto es lo que ocurre cuando se combinan el sodio y el cloro. El sodio tiene un único electrón en su capa más externa, y lo pierde con facilidad. De este modo su capa más externa pasa a ser una capa completa. Por su parte, el cloro tiene siete electrones en su capa más externa y facilidad para ganar otro electrón. De esta forma completa su última capa de electrones. El electrón de la capa más externa del sodio es transferido a la capa más externa del sodio, quedando ambos con su capa más externa completa. En este momento el sodio tiene 11 protones en su núcleo y 10 electrones en su corteza, por lo que tiene una carga de +1, y lo representamos como Na+. El cloro tiene ahora 17 protones en su núcleo y 18 electrones en su corteza, por lo que tiene una carga de -1, y lo representamos como Cl-.
El enlace iónico se basa en la transferencia de electrones, con lo que se forman átomos con carga eléctrica, llamados iones. Los iones positivos se llaman cationes, y los negativos, aniones. Una vez formados los cationes y los aniones, se establecen entre ellos fuerzas de atracción electrostática, lo que conduce a la formación del enlace.
Generalmente, un elemento alcalino o del Grupo I A ( Li, Na, K, Rb, Cs, Fr ) y un elemento halógeno o del Grupo VII A ( F, Cl, Br, I ) , formarán cristales iónicos. Algunos de los compuestos que mantienen enlaces iónicos se encuentran NaCl, LiF, KBr, NaF, KI, CaO, MgO, BeO, MgS, BaS, RbSe. (Como se puede observar el enlace se da entre un metal y un no metal)
Características de los compuestos iónicos:
•Son sólidos cristalinos, de estructura muy ordenada, en forma de red.
•Punto de fusión elevado, por lo general más de 400 º C. Esto es consecuencia de la fuerza de atracción que une los iones cuando se encuentran formando la red cristalina.
•Las uniones por fuerza electrostática se rompen con facilidad al agregar un solvente polar, agua por ejemplo, disolviendo el compuesto, obteniéndose los aniones y cationes por separado. Los compuestos iónicos, en estado líquido o disuelto, conducen la electricidad, gracias a la movilidad de sus iones. En cambio, en estado sólido, el compuesto no es conductor, debido a la gran fuerza de atracción que existe entre los iones cuando se encuentran en forma de cristal, que no les permite moverse y conducir la corriente eléctrica.
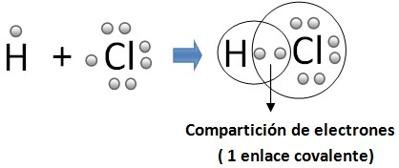
ENLACE COVALENTE
se definen como la unión que se produce entre 2 átomos por la compartición de 2 o más electrones de su capa externa, con objeto de formar una molécula estable.
COMPUESTOS COVALENTES
Hay que distinguir entre aquellos en los que la formación de enlaces de tipo covalente da lugar a compuestos moleculares y otros en los que se forman redes tridimensionales:
Las redes covalentes se forman por átomos que se unen entre sí por uniones covalentes, por ello la fuerza de unión es fuerte. Las propiedades de este tipo de compuesto vendrán definidas por este hecho:
- Presentan elevados puntos de fusión (generalmente subliman si se sigue calentando)
- Muy poco solubles en cualquier tipo de disolvente.
- Suelen ser duros.
- Suelen ser malos conductores de la electricidad.
Las sustancias covalentes moleculares se caracterizan porque sus átomos se unen mediante enlaces covalentes, pero forman entidades moleculares individuales. Éstas interaccionan entre sí mediante fuerzas intermoleculares, siendo el tipo de fuerza intermolecular presente la responsable de las propiedades que presentan las sustancias:
- Se pueden presentar en estado sólido, líquido o gaseoso a temperatura ambiente. En general, sus puntos de fusión y ebullición no son elevados, aunque serán mayores cuando las fuerza intermolecular que une a las moléculas sea más intensa.
- Suelen ser blandas y elásticas, pues al rayarlas sólo se rompen las fuerzas intermoleculares.
- La solubilidad es variable, siendo solubles en disolventes de polaridad similar. Los compuestos polares se disuelven en disolventes polares, los apolares en los disolventes apolares.
- En general, son malos conductores de la electricidad. Aunque la conductividad eléctrica se ve favorecida si aumenta la polaridad de las moléculas.

No hay comentarios:
Publicar un comentario