Es la fuerza existente dos o mas átomos que los mantiene unidos en las moléculas.
Al producirse un acercamiento entre dos o mas átomos , puede darse una fuerza de atracción entre los electrones de los átomos y el núcleo de uno u otro atomo.
Si esta fuerza llega a ser lo suficientemente grande para mantener los átomos unidos , se ha formado un enlace químico.
Regla del octeto y estructura de Lewis
A inicios del siglo XX, en 1916, de manera independiente, los científicos Walter Kossel y Gilbert Lewis concluyeron que la tendencia que poseen los átomos de lograr estructuras similares a las del gas noble más cercano explica la formación de los enlaces químicos. Esta conclusión es mundialmente conocida como la Regla del Octeto y se enuncia de la siguiente manera:
“Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico”.

TIPOS DE ENLACE
Existen tres tipos de enlaces entre átomos: el enlace iónico, el enlace covalente.
Enlaces Iónicos
En los enlaces iónicos, los electrones se transfieren completamente de un átomo a otro. Durante este proceso de perder o ganar electrones cargados negativamente, los átomos que reaccionan forman iones. Lo iones cargados de manera opuesta se atraen entre ellos a través de fuerzas electroestáticas que son la base del enlace iónico.
Por ejemplo, durante la reacción del sodio con el cloro:


resultando en
un ión de sodio cargado positivamente (izquierda) y un ión de cloro cargado negativamente (derecha).

Note que cuando el sodio pierde su electrón de valencia, se hace más pequeño, mientras que el cloro se hace más grande cuando gana una valencia de electrón adicional. Esto es típico de los tamaños relativos de iones a átomos. Después que la reacción tiene lugar, los iones cargado Na+ y Cl- se sujetan gracias a las fuerzas electroestáticas, formando así un enlace ionico. Los compuestos iónicos comparten muchas caractéristicas en común:
Los enlaces iónicos se forman entre metales y no metales.
Al nombrar compuestos iónicos simples, el metal siempre viene primero, el no metal segundo (por ejemplo, el cloruro de sodio).
Los compuestos iónicos se disuelven facilmente en el agua y otros solventes polares.
En una solución, los compuestos iónicos fácilmente conducen electricidad.
Los compuestos iónicos tienden a formar sólidos cristalinos con temperaturas muy altas.
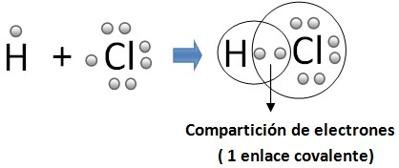
ENLACES COVALENTES
El segundo mayor tipo de enlace atómico ocurre cuando los átomos comparten electrones. Al contrario de los enlaces iónicos en los cuales ocurre una transferencia completa de electrones, el enlace covalente ocurre cuando dos (o más) elementos comparten electrones. El enlace covalente ocurre porque los átomos en el compuesto tienen una tendencia similar hacia los electrones (generalmente para ganar electrones). Esto ocurre comúnmente cuando dos no metales se enlazan. Ya que ninguno de los no elementos que participan en el enlace querrán ganar electrones, estos elementos compartirán electrones para poder llenar sus envolturas de valencia.

Enlaces Múltiples: Para cada par de electrones compartidos entre dos átomos, se forma un enlace covalente único. Algunos átomos pueden compartir múltiples pares de electrones, formando enlaces covalentes múltiples. Por ejemplo, el oxígeno (que tiene seis electrones de valencia) necesita dos electrones para completar su envoltura de valencia. Cuando dos átomos de oxígeno forman el compuesto O2, ellos comparten dos pares de electrones, formando dos enlaces covalentes.

Enlaces Polares y No-Polares
En realidad, hay dos sub tipos de enlaces covalente. La molécula H2 es un buen ejemplo del primer tipo de enlace covalente el enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar .
Un enlace polar se forma cuando los electrones son desigualmente compartidos entre dos átomos. Los enlaces polares covalentes ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace polar covalente, los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace polar covalente es el enlace hidrógeno - oxígeno en la molécula de agua.

Propiedades de las sustancias covalentes
Las sustancias covalentes en general se caracterizan porque:
Tienen bajos puntos de fusión y de ebullición.
Cuando se trata de cuerpos sólidos, son relativamente blandos y malos conductores del calor y de la electricidad.
Son bastante estables y de escasa reactividad (el enlace covalente es fuerte).
Por tanto, en las sustancias covalentes podemos distinguir:
Gases, como O2, H2, N2, CO2. Los átomos en cada molécula están unidos por enlaces covalentes, pero entre ellas las fuerzas de unión son muy débiles; las moléculas están dispersas y, por tanto, forman sustancias gaseosas.
Líquidos, como el H2O. Las fuerzas de unión entre las moléculas de agua son más intensas. Las moléculas permanecen en contacto, aunque con libertad para deslizarse unas sobre otras. Por tanto, esta sustancia, agua, es líquida.
Sólidos, como el yodo, el diamante o el óxido de silicio (cuarzo). Estos dos últimos son muy duros, mucho más que los sólidos iónicos, y con altos puntos de fusión y ebullición. En el diamante, cada átomo de carbono se une con otros cuatro, formando una red cristalina covalente.